
AMINOKWASY
Aminokwasy s▒ podstawowymi elementami bia│ek. Sk│adaj▒ siΩ z: grupy aminowej, grupy karboksylowej, atomu wodoru oraz specyficznej dla ka┐dego aminokwasu grupy R. Wszystkie te elementy skupione s▒ wok≤│ wΩgla a .
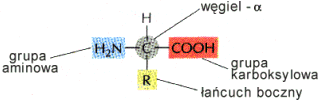
Centralny wΩgiel po│▒czony jest z czterema r≤┐nymi podstawnikami, co powoduje, ┐e jest on asymetryczny. Zwi▒zane jest to z dwoma mo┐liwymi u│o┐eniami grup otaczaj▒cych wΩgiel.
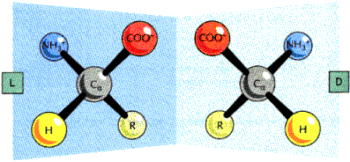
Te dwie formy nazywa siΩ izomerami optycznymi. W przestrzeni tr≤jwymiarowej nie jest mo┐liwa zamiana ich w siebie bez zniszczenia struktury. S▒ one wzajemnymi odbiciami lustrzanymi. Wszystkie aminokwasy spotykane w organizmach ┐ywych wystΩpuj▒ w formie l. Dlatego, m≤wi▒c o nich, pomija siΩ ten element w nazwie: np. zamiast o l-alaninie m≤wi siΩ o alaninie.
W roztworze o pH=7 (obojΩtnym) aminokwasy wystΩpuj▒ w formie jon≤w obojnaczych. Grupa aminowa posiada │adunek dodatni (NH3+), a grupa karboksylowa û ujemny (COOû). Tak▒ formΩ nazywamy jonem obojnaczym. Gdy pH otoczenia ulegnie zmianie, zmienia siΩ te┐ stan jonizacji cz▒steczki aminokwasu. Wraz ze wzrostem pH (zmniejszenie stΩ┐enia jon≤w H+), zaczyna przewa┐aµ forma o niezjonizowanej grupie NH3. Gdy pH spada (wzrost stΩ┐enia H+), grupa aminowa ulega jonizacji, podczas, gdy grupa karboksylowa przyjmuje formΩ COOH.

W bia│kach wystΩpuje zestaw 20 podstawowych aminokwas≤w. Ten zestaw jest jednolity dla ca│ego ╢wiata o┐ywionego. Choµ spotkaµ mo┐na r≤wnie┐ aminokwasy spoza podstawowej dwudziestki, s▒ one g│≤wnie efektem modyfikacji posttranslacyjnych.
Aminokwasy r≤┐ni▒ siΩ jedynie │a±cuchami bocznymi (R) û reszta element≤w pozostaje niezmieniona. Grupy boczne r≤┐niµ siΩ mog▒:
- kszta│tem
- wielko╢ci▒
- │adunkiem elektrycznym
- reaktywno╢ci▒
- zdolno╢ci▒ do tworzenia wi▒za± wodorowych i hydrofobowych
Bior▒c pod uwagΩ w│a╢ciwo╢ci grupy R, aminokwasy mo┐na podzieliµ na: hydrofobowe i hydrofilowe, a w obrΩbie tej grupy dodatkowo na kwasowe, zasadowe i niena│adowane.
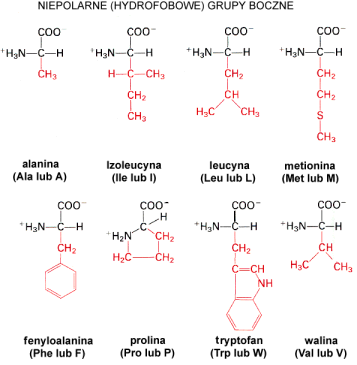
Aminokwasy hydrofobowe
Do tej grupy zaliczamy alaninΩ, kt≤rej grup▒ boczn▒ jest grupa metylowa. Trzy i czterowΩglowe │a±cuchy boczne posiadaj▒ walina, leucyna i izoleucyna. Izoleucyna charakteryzuje siΩ obecno╢ci▒ dw≤ch centr≤w aktywnych optycznie. Alifatyczny │a±cuch boczny proliny zapΩtlony jest tak, ┐e │▒czy siΩ r≤wnie┐ z grup▒ aminow▒. Kolejny aminokwas û fenyloalanina û zawiera pier╢cie± fenylowy po│▒czony z grup▒ metylenow▒ (ûCH2û).úa±cuchem bocznym tryptofanu jest pier╢cie± indolowy po│▒czony z grup▒ metylow▒, wodorami i atomem azotu. Ostatnim aminokwasem z grupy hydrofobowych jest metionina. Zawiera ona w swej grupie bocznej atom siarki.
Ta grupa aminokwas≤w wykazuje silne w│a╢ciwo╢ci hydrofobowe. Ta tendencja do unikania kontaktu z wod▒ i zdolno╢µ do grupowania siΩ maj▒ znaczenie dla stabilizacji struktury bia│ek w ╢rodowisku wodnym.
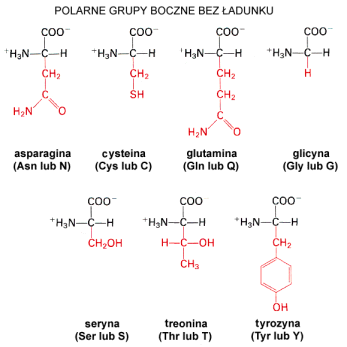
Aminokwasy polarne nie posiadaj▒ce │adunku
Najprostszym aminokwasem w tej grupie jest glicyna û jej grupΩ boczn▒ stanowi jedynie atom wodoru. W wyniku tego glicyna nie wykazuje czynno╢ci optycznej (nie jest asymetryczna). Tyrozyna posiada │a±cuch boczny w postaci pier╢cienia aromatycznego z do│▒czon▒ grup▒ hydroksylow▒, kt≤ra powoduje, ┐e aminokwas ten charakteryzuje siΩ dosyµ du┐▒ reaktywno╢ci▒ chemiczn▒. Cysteina zawiera w swej grupie bocznej atom siarki w postaci grupy hydrosulfidowej (SH). Grupa ta jest silnie reaktywna i bierze udzia│ w tworzeniu mostk≤w dwusiarczkowych wp│ywaj▒cych na strukturΩ niekt≤rych bia│ek. Kolejnymi aminokwasami nale┐▒cymi polarnymi s▒ seryna i treonina zawieraj▒ce w alifatycznym │a±cuchu bocznym grupy hydroksylowe. Podobnie jak w przypadku tyrozyny, grupy te powoduj▒ wzrost reaktywno╢ci. Treonina, obok izoleucyny, jest jednym z dw≤ch aminokwas≤w posiadaj▒cych dwa centra optyczne. Asparagina i glutamina, ostatnie z grupy, s▒ pochodnymi asparaginianu i glutaminianu powsta│ymi w wyniku do│▒czenia grupy amidowej.
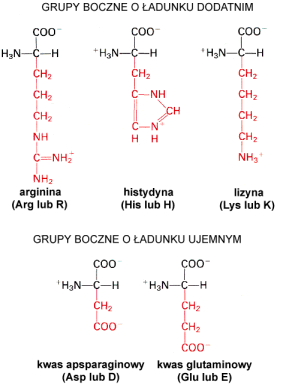
Aminokwasy polarne o │adunku dodatnim
W ╢rodowisku o odczynie obojΩtnym lizyna i arginina maj▒ │adunek dodatni, podczas gdy histydyna │atwo mo┐e przechodziµ miΩdzy │adunkiem dodatnim, a obojΩtnym. W│a╢ciwo╢µ ta jest wykorzystana w centrach aktywnych enzym≤w, gdzie histydyna zmieniaj▒c stany na│adowania katalizuje powstawanie i zrywanie wi▒za±.
Aminokwasy polarne o │adunku ujemnym
Do tej grupy nale┐▒ tylko dwa aminokwasy o podobnej budowie: asparaginian (kwas asparaginowy) i glutaminian (kwas glutaminowy). úa±cuchy boczne tych aminokwas≤w w fizjologicznym zakresie pH posiadaj▒ │adunek ujemny.
Przy oznaczaniu aminokwas≤w czΩsto stosuje siΩ skr≤ty jedno b▒d╝ trzyliterowe. Jest to szczeg≤lnie przydatne przy opisywaniu │a±cucha polipeptydowego. Poni┐ej zestawiono aminokwasy wraz z ich skr≤tami i opisuj▒cymi je kodonami nukleotydowymi.
|
A |
Ala |
alanina |
GCA GCC GCG GCU |
|
C |
Cys |
cysteina |
UGC UGU |
|
D |
Asp |
asparaginian |
GAC GAU |
|
E |
Glu |
glutaminian |
GAA GAG |
|
F |
Phe |
fenyloalanina |
UUC UUU |
|
G |
Gly |
glicyna |
GGA GGC GGG GGU |
|
H |
His |
histydyna |
CAC CAU |
|
I |
Ile |
izoleucyna |
AUA AUC AUU |
|
K |
Lys |
lizyna |
AAA AAG |
|
L |
Leu |
leucyna |
UUA UUG CUA CUC CUG CUU |
|
M |
Met |
metionina |
AUG |
|
N |
Asn |
asparagina |
AAC AAU |
|
P |
Pro |
prolina |
CCA CCC CCG CCU |
|
Q |
Gln |
glutamina |
CAA CAG |
|
R |
Arg |
arginina |
AGA AGG CGA CGC CGG CGU |
|
S |
Ser |
seryna |
AGC AGU UCA UCC UCG UCU |
|
T |
Thr |
treonina |
ACA ACC ACG ACU |
|
V |
Val |
walina |
GUA GUC GUG GUU |
|
W |
Trp |
tryptofan |
UGG |
|
Y |
Tyr |
tyrozyna |
UAC UAU |

⌐ 1997, 1998 Biologia Molekularna w Internecie Webmaster







