
WIíZANIA
Wi▒zanie chemiczne jest si│▒ przyci▒gaj▒c▒ do siebie atomy i utrzymuj▒c▒ je razem. Powstaj▒ce w wyniku tych oddzia│ywa± zgrupowania atom≤w nazywamy cz▒steczkami (moleku│ami).
Wi▒zania chemiczne opisaµ mo┐na kilkoma w│a╢ciwo╢ciami. Podstawow▒ jest si│a wi▒zania. Wi▒zaniami silnymi s▒ wi▒zania kowalencyjne. Nie ulegaj▒ one samorzutnemu rozerwaniu w temperaturach fizjologicznych. Wi▒zania s│abe wystΩpuj▒ce pojedynczo │atwo ulegaj▒ rozpadowi ju┐ w stosunkowo niskich temperaturach. Istotnego znaczenia nabieraj▒ dopiero, gdy wystΩpuj▒ w grupach.
D│ugo╢µ wi▒zania jest zwi▒zana z jego si│▒: im wi▒zanie silniejsze, tym bli┐ej siebie znajduj▒ siΩ atomy. Dwa atomy wodoru po│▒czone wi▒zaniem kowalencyjnym znajduj▒ siΩ w odleg│o╢ci 0,74 angstrem≤w, podczas gdy w przypadku oddzia│ywa± van der Waalsa odleg│o╢µ ta wynosi 1,2 angstrema.
Wi▒zania r≤┐niµ siΩ mog▒ swobod▒ rotacji. Pojedyncze wi▒zanie kowalencyjne pozwala na dowolny obr≤t po│▒czonych atom≤w wok≤│ osi wi▒zania. Wi▒zania podw≤jne i potr≤jne s▒ sztywne i nie dopuszczaj▒ obrot≤w.
W uk│adach biologicznych zasadnicz▒ rolΩ odgrywa kilka typ≤w wi▒za± chemicznych. Silniejsze i bardziej stabilne s▒ wi▒zania kowalencyjne. Wi▒zania niekowalencyjne, choµ s│absze, odgrywaj▒ istotn▒ rolΩ stabilizuj▒c struktury biologiczne takie jak bia│ka, kwasy nukleinowe czy b│ony kom≤rkowe.
Wi▒zania kowalencyjne
Tworzenie wi▒za± kowalencyjnych polega na uwsp≤lnianiu elektron≤w. Zachodzi ono pomiΩdzy dwoma elektroujemnymi atomami d▒┐▒cymi do przy│▒czenia elektron≤w. J▒dra tych atom≤w znajduj▒ siΩ blisko siebie poniewa┐ elektrony ich zewnΩtrznych pow│ok poruszaj▒ siΩ swobodnie po orbitalach wsp≤lnych dla obu atom≤w.
NajczΩ╢ciej wystΩpuj▒cymi atomami
WiΩkszo╢µ cz▒steczek organicznych sk│ada siΩ z atom≤w sze╢ciu pierwiastk≤w: wodoru, wΩgla, azotu, fosforu, tlenu i siarki. ZewnΩtrzne pow│oki tych atom≤w posiadaj▒ charakterystyczne dla nich liczby elektron≤w:
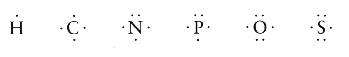
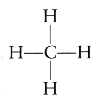
Atomy te │atwo tworz▒ wi▒zania kowalencyjne i rzadko wystΩpuj▒ pojedynczo. Zazwyczaj ka┐dy z nich tworzy typow▒ dla siebie liczbΩ wi▒za±. Wod≤r z jednym elektronem w pow│oce tworzyµ mo┐e tylko jedno wi▒zanie. WΩgiel posiadaj▒cy w zewnΩtrznej pow│oce cztery elektrony tworzy najczΩ╢ciej cztery wi▒zania kowalencyjne - przyk│adem mo┐e byµ cz▒steczka metanu (CH4):
Siarka i tlen, pomimo sze╢ciu elektron≤w w pow│okach zewnΩtrznych, tworz▒ zwykle dwa wi▒zania jak na przyk│ad w tlenie cz▒steczkowym (O2) czy dwutlenku siarki (H2S):
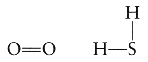
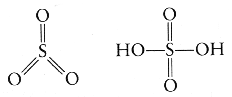
Jednak atom siarki formowaµ mo┐e nawet sze╢µ wi▒za± - tr≤jtlenek siarki (SO3) czy kwas siarkowy (H2SO4):
Azot i fosfor maj▒ce po piΩµ elektron≤w zewnΩtrznych tworzyµ mog▒ trzy (amoniak NH3) lub piΩµ wi▒za± kowalencyjnych (kwas ortofosforowy H3PO4):
Elektroujemno╢µ i dipole
Ka┐dy z atom≤w charakteryzuje pewna warto╢µ zwana elektroujemno╢ci▒. Opisuje ona tendencjΩ atomu do przyci▒gania do siebie elektron≤w - im wy┐sza elektroujemno╢µ tym silniejsze przyci▒ganie. Najwy┐sz▒ elektroujemno╢µ (4) ma atom fluoru.
|
Pierwiastek |
Elektroujemno╢µ |
|
Fluor |
4,0 |
|
Tlen |
3,5 |
|
Chlor |
3,0 |
|
Azot |
3,0 |
|
Brom |
2,8 |
|
Siarka |
2,5 |
|
WΩgiel |
2,5 |
|
Jod |
2,5 |
|
Fosfor |
2,1 |
|
Wod≤r |
2,1 |
|
Magnez |
1,2 |
|
Wap± |
1,0 |
|
Lit |
1,0 |
|
S≤d |
0,9 |
|
Potas |
0,8 |
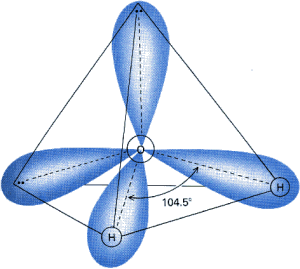
Je┐eli wi▒zanie tworz▒ atomy pierwiastk≤w o r≤┐nej elektroujemno╢ci, to jedno z j▒der atomowych przyci▒ga elektrony z wiΩksz▒ si│▒ ni┐ drugie. Prowadzi to do deformacji chmury elektronowej i nier≤wnomiernego roz│o┐enia │adunku na cz▒steczce. Tak▒ cz▒steczkΩ nazywamy w≤wczas dipolem i m≤wimy, ┐e jest ona polarna. Dobrym przyk│adem jest tu cz▒steczka wody: du┐a r≤┐nica elektroujemno╢ci miΩdzy tlenem, a wodorem powoduje przesuniΩcie chmury elektronowej. Poniewa┐ oba atomy wodoru znajduj▒ siΩ po jednej stronie cz▒steczki, jej moment dipolowy jest wysoki, a cz▒steczka silnie polarna.
Dwa atomy identyczne lub o takiej samej elektroujemno╢ci po│▒czone wi▒zaniem kowalencyjnym tworz▒ cz▒steczkΩ niepolarn▒ - elektrony przyci▒gane s▒ z tak▒ sam▒ si│▒, a cz▒steczka nie jest dipolem. Z takim uk│adem mamy do czynienia np. w przypadku wi▒zania C ù C.
Polarno╢µ cz▒steczek ma ogromny wp│yw na ich w│a╢ciwo╢ci chemiczne, a co za tym idzie - biologiczne. Jest ona ╢ci╢le zwi▒zana z hydrofobowym lub hydrofilowym charakterem pewnych struktur. Odgrywa to kluczow▒ rolΩ w tak istotnych sprawach, jak budowa b│on biologicznych czy fa│dowanie bia│ek.
Wi▒zania niekowalencyjne
Choµ silne wi▒zania kowalencyjne trzymaj▒ razem atomy w cz▒steczce, istnieje grupa s│abych oddzia│ywa± o charakterze niekowalencyjnym odpowiedzialnych za utrzymywanie tr≤jwymiarowej struktury oraz za wzajemne oddzia│ywania z│o┐onych moleku│. Nale┐▒ do niej wi▒zania wodorowe, jonowe, si│y van der Waalsa oraz oddzia│ywania hydrofobowe. Oddzia│ywania te maj▒ stosunkowo niewielk▒ energiΩ, jednak tam, gdzie wystΩpuj▒ licznie, ich si│a sumuje siΩ i zyskiwaµ mog▒ istotny wp│yw na budowΩ cz▒steczek.
Wi▒zania wodorowe
Atom wodoru │▒czyµ siΩ mo┐e normalnie tylko jednym wi▒zaniem kowalencyjnym. Jednak wod≤r zdolny jest do utworzenia dodatkowego wi▒zania wodorowego. Jest to s│abe oddzia│ywanie elektrostatyczne pomiΩdzy elektroujemnym atomem (akceptorem), a atomem wodoru, kt≤ry jest kowalencyjnie po│▒czony z innym atomem elektroujemnym (donorem). W wi▒zaniu tym wod≤r pe│ni rolΩ mostka │▒cz▒cego dwa elektroujemne atomy.
We wzorach wi▒zanie wodorowe oznacza siΩ zwykle lini▒ przerywan▒:
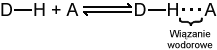
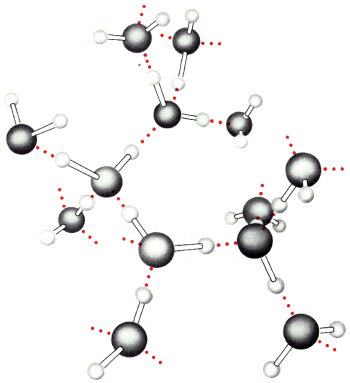
Wi▒zanie kowalencyjne pomiΩdzy donorem, a atomem wodoru ma charakter dipolarny, natomiast zewnΩtrzna pow│oka akceptora posiadaµ musi niesparowane elektrony. Klasycznym przyk│adem takich oddzia│ywa± s▒ wi▒zania pomiΩdzy cz▒steczkami wody: atom wodoru nale┐▒cy do jednej cz▒steczki przyci▒gany jest przez parΩ elektron≤w z zewnΩtrznej pow│oki atomu tlenu cz▒steczki s▒siedniej.
Znaczenie w uk│adach biologicznych mog▒ mieµ jedynie wi▒zania wodorowe pomiΩdzy trzema pierwiastkami: P, O, N. Jedynie te atomy maj▒ odpowiedni stosunek elektroujemno╢ci do rozmiaru atomu, aby utworzyµ trwa│e wi▒zania wodorowe.
Istotn▒ cech▒ wi▒za± wodorowych jest ich kierunkowo╢µ. Najsilniejsze oddzia│ywanie ma miejsce wtedy, gdy trzy uczestnicz▒ce w wi▒zaniu atomy (donor, wod≤r i akceptor) po│o┐one s▒ na jednej linii.
Wi▒zania wodorowe s▒ silniejsze w wypadku, gdy │▒cz▒ce siΩ cz▒steczki rozpuszczone s▒ w niepolarnym rozpuszczalniku. W roztworach o wysokiej polarno╢ci oddzia│ywania s▒ s│absze, poniewa┐ czΩsto pojawiaj▒ siΩ wi▒zania pomiΩdzy substancj▒ rozpuszczon▒, a polarnymi cz▒steczkami rozpuszczalnika.
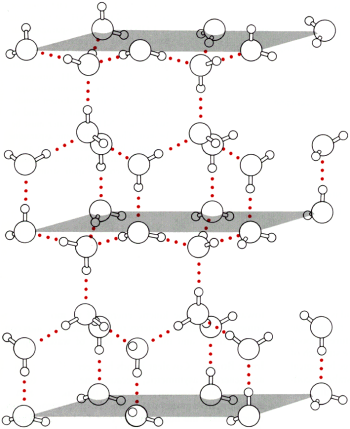
Podstawowe znaczenie dla w│a╢ciwo╢ci i budowy wody maj▒ wi▒zania wodorowe. Powoduj▒ one, ┐e silnie oddzia│uj▒ce miΩdzy sob▒ cz▒steczki H2O przechodziµ w stan gazowy zaczynaj▒ dopiero przy 100░ C. Gdyby nie istnienie wi▒za± wodorowych ca│a woda na Ziemi znajdowa│a by siΩ w postaci pary wodnej. R≤wnie┐ l≤d zawdziΩcza swoje niezwyk│e w│a╢ciwo╢ci tym s│abym oddzia│ywaniom. Ka┐dy atom tlenu │▒czy siΩ dwoma wi▒zaniami kowalencyjnymi z atomami wodoru, oraz dwoma wi▒zaniami wodorowymi z s▒siednimi cz▒steczkami.
rys 9Wi▒zania wodorowe wp│ywaj▒ nie tylko na temperaturΩ wrzenia i rozpuszczalno╢µ zwi▒zk≤w, lecz tak┐e odgrywaj▒ zasadnicz▒ rolΩ przy tworzeniu tr≤jwymiarowych struktur makrocz▒steczek takich jak bia│ka i kwasy nukleinowe. Hemoglobina zawdziΩcza istnienie kieszeni umo┐liwiaj▒cej wi▒zanie tlenu w│a╢nie temu typowi oddzia│ywa±. R≤wnie┐ fakt, ┐e DNA tworzy strukturΩ podw≤jnego heliksu wynika z istnienia wewnΩtrznych wi▒za± o charakterze wodorowym.
Wi▒zania jonowe
W przypadku wi▒za± kowalencyjnych chmura elektronowa przesuniΩta jest zazwyczaj w kierunku atomu o wiΩkszej elektroujemno╢ci. Kiedy takie wi▒zanie pΩka, elektrony pozostaj▒ z atomem o wiΩkszej elektroujemno╢ci; staje siΩ on jonem o ujemnym │adunku - anionem. Drugi atom z rozerwanej pary pozbawiony zostaje elektron≤w i nabywaj▒c │adunek dodatni staje siΩ kationem.
W niekt≤rych uk│adach r≤┐nica elektroujemno╢ci pomiΩdzy atomami bior▒cymi udzia│ w wi▒zaniu jest na tyle du┐a, ┐e elektrony przeci▒gniΩte zostaj▒ ca│kowicie na stronΩ jednego z nich. Taka sytuacja ma miejsce w cz▒steczce NaCl. Du┐a r≤┐nica elektroujemno╢ci (Na 0,9; Cl 3,0) powoduje, ┐e elektrony nie s▒ ju┐ dzielone pomiΩdzy atomami (jak w wi▒zaniu kowalencyjnym), lecz przeniesione ca│kowicie na atom chloru. Tak wiΩc w rzeczywisto╢ci mamy do czynienia z nastΩpuj▒cym rozk│adem │adunk≤w: Na+Cl-. Atomy takiej cz▒steczki po│▒czone s▒ wi▒zaniem jonowym. Jest to oddzia│ywanie pomiΩdzy │adunkami o przeciwnych znakach.
W roztworach wodnych, jony o znaczeniu biologicznym, takie jak Na+, K+, Ca2+, Mg2+ czy Clû nie wystΩpuj▒ w stanie wolnym, lecz tworz▒ z cz▒steczkami wody uk│ady powi▒zane oddzia│ywaniami o charakterze jonowym. Przyk│adem mo┐e byµ uk│ad woda - kation potasowy:
Si│y van der Waalsa
Si│y van der Waalsa s▒ bardzo s│abymi oddzia│ywaniami zachodz▒cymi pomiΩdzy wszystkimi typami atom≤w (zar≤wno polarnymi jak i niepolarnymi). W chmurze elektronowej otaczaj▒cej j▒dro pojawiaµ siΩ mog▒ chwilowe fluktuacje rozmieszczenia │adunk≤w ujemnych - wynik normalnego ruchu elektron≤w. Takie nieregularno╢ci prowadz▒ do powstawania i zanikania dipoli, kt≤re wp│ywaj▒ na rozmieszczenie elektron≤w w s▒siednich atomach. Gdy atomy znajduj▒ce siΩ w bezpo╢rednim s▒siedztwie maj▒ spolaryzowane chmury elektronowe, pojawiaµ siΩ mo┐e s│abe przyci▒ganie. Zanika ono bardzo szybko wraz ze wzrostem odleg│o╢ci miΩdzy atomami, natomiast gdy atomy znajd▒ siΩ zbyt blisko siebie zostaj▒ odepchniΩte przez jednoimienne │adunki chmur elektronowych.
Pomimo, ┐e si│y te wystΩpuj▒ przez bardzo kr≤tki czas (rzΩdu 10-9 s) i s▒ bardzo s│abe (ok. 1kcal/mol), sumuj▒c siΩ wywo│uj▒ efekty o du┐ym znaczeniu biologicznym i chemicznym. Oddzia│ywania van der Waalsa odpowiadaj▒ na przyk│ad za przyci▒ganie siΩ cz▒steczek niepolarnych cieczy oraz stanowi▒ si│y │▒cz▒ce sk│adniki ╢cian kom≤rkowych (poprzez przyci▒ganie siΩ niepolarnych │a±cuch≤w fosfolipid≤w).
Oddzia│ywania hydrofobowe
Cz▒steczki niepolarne nie zawieraj▒ spolaryzowanych wi▒za± ani atom≤w - powoduje to, ┐e s▒ one nierozpuszczalne w wodzie. W│a╢ciwo╢µ t▒ nazywa siΩ hydrofobowo╢ci▒. Hydrofobowe mog▒ byµ r≤wnie┐ fragmenty cz▒steczek: przyk│adem mo┐e byµ cz▒steczka tristearynianu:

Sk│ada siΩ ona z trzech reszt kwasu stearynowego po│▒czonych z glicerolem. Trzy │a±cuchy stanowi▒ silnie hydrofobow▒ czΩ╢µ cz▒steczki (du┐o niespolaryzowanych wi▒za± wΩgielùwΩgiel), natomiast fragment glicerolowy wykazuje w│asno╢ci hydrofilowe (polarne wi▒zania wΩgielùtlen).
W ╢rodowisku wodnym oddzia│ywanie z polarnymi cz▒steczkami H2O doprowadzi do takiego uk│adu, w kt≤rym fragmenty hydrofobowe bΩd▒ ôunika│yö kontaktu z wod▒ grupuj▒c siΩ razem, natomiast czΩ╢ci hydrofilowe ôchΩtnieö bΩd▒ z ni▒ oddzia│ywaµ. Si│y wywo│uj▒ce to zjawisko nazywane s▒ oddzia│ywaniami hydrofobowymi. Nie s▒ to wi▒zania w ╢cis│ym tego s│owa znaczeniu, gdy┐ │▒czenie siΩ fragment≤w hydrofobowych jest zjawiskiem wt≤rnym, wywo│anym ôniechΩci▒ö do cz▒steczek wody. ¼r≤d│em energii oddzia│ywa± hydrofobowych jest niechΩµ cz▒steczek wody zwiΩkszenia stopnia organizacji. Rozpuszczenie w H2O niepolarnych cz▒steczek wymaga u│o┐enia moleku│ wody w warstwΩ otaczaj▒c▒ cz▒steczkΩ. Ogranicza to ich mo┐liwo╢µ ruchu i jest niekorzystne energetycznie. Szczeg≤lnie wyra╝ne jest to w przypadku du┐ych struktur niepolarnych (jak na przyk│ad │a±cuchy reszt kwasu stearynowego), kt≤rych rozpuszczenie wymaga│oby zaanga┐owania du┐ej ilo╢ci cz▒steczek wody. Kr≤tkie struktury (np. butan: CH3 ùCH2 ùCH2 ùCH3), pomimo charakteru niepolarnego, s▒ czΩ╢ciowo rozpuszczalne w wodzie: nie powoduje to du┐ego ograniczenia swobody ruchu cz▒steczek wody.
 CHEMICZNE PODSTAWY BIOLOGII MOLEKULARNEJ
CHEMICZNE PODSTAWY BIOLOGII MOLEKULARNEJ

⌐ 1997, 1998 Biologia Molekularna w Internecie Webmaster






