Budowa bia│ek
Bia│ka powstaj▒ w wyniku polikondensacjia-L-aminokwas≤w. Reakcja ta zachodzi przy udziale wyspecjalizowanych kompleks≤w enzymatycznych - rybosom≤w, we wszystkich kom≤rkach organizm≤w ┐ywych i jest okre╢lana mianem translacji.
Na podstawie kodu genetycznego s▒ syntetyzowane polipeptydy o ╢ci╢le okre╢lonej sekwencji aminokwas≤w. W zale┐no╢ci od liczby aminokwas≤w, mo┐na wyr≤┐niµ dipeptydy, tripeptydy itd. Dla peptyd≤w utworzonych z kilku do kilkunastu aminokwas≤w stosuje siΩ og≤ln▒ nazwΩ û oligopeptydy, natomiast dla cz▒steczek zbudowanych z kilkudziesiΩciu (do ok. 100) aminokwas≤w û polipeptydy. Bia│ka to zwi▒zki wielkocz▒steczkowe (makromolekularne), kt≤rych pojedyncze │a±cuchy polipeptydowe mog▒ dochodziµ do ponad 1000 cz▒steczek aminokwas≤w.
|
Opis cz▒steczki |
Wygl▒d cz▒steczki |
Liczba aminokwas≤w |
|
Peptydy |
|
od 2 |
|
Oligopeptydy |
|
kilka - kilkana╢cie |
|
Polipeptydy |
|
poni┐ej 100 |
|
Bia│ka |
|
powy┐ej 100 |
Du┐e bia│ka mog▒ zawieraµ kilka takich │a±cuch≤w, a w przypadku bia│ek z│o┐onych û tak┐e elementy niebia│kowe (np.: reszty cukrowe, lipidowe lub jony metali). Peptydy s▒ amidami utworzonymi w wyniku rekcji grup aminowych z grupami karboksylowymi aminokwas≤w, wi▒zanie chemiczne wystΩpuj▒ce w tych zwi▒zkach jest okre╢lone mianem wi▒zania peptydowego. Wyr≤┐niono dwa ko±ce cz▒steczki:
N-terminalny, ze wzglΩdu na woln▒ grupΩ aminow▒ (+H3N-), zapisywan▒ z lewej, oraz C-terminaln▒ oznaczaj▒c▒ grupΩ karboksylow▒ ( -COO- ), kt≤r▒ zapisujΩ siΩ z prawej strony cz▒steczki. Oba ko±ce cz▒steczki s▒ reaktywne. U│o┐enie poszczeg≤lnych aminokwas≤w w │a±cuchu zapisuje siΩ, stosuj▒c skr≤ty trzy-, lub jednoliterowe. Wz≤r cz▒steczki peptydu mo┐na zatem sobie wyobraziµ jako │a±cuch szeregowo u│o┐onych wi▒za± peptydowych, porozdzielanych ôwΩz│amiö atom≤w wΩgla, od kt≤rych odchodz▒ boczne │a±cuchy û reszty aminokwasowe

. W│a╢nie te boczne odga│Ωzienia reszt aminokwasowych, dziΩki swej r≤┐norodno╢ci chemicznej decyduj▒ o reaktywno╢ci, kszta│cie i funkcji cz▒steczki polipeptydu. Rodzaj i wzajemne powi▒zania aminokwas≤w wchodz▒cych w sk│ad │a±cucha polipeptydowego decyduj▒ o charakterze, funkcji i w│a╢ciwo╢ciach fizyko-chemicznych cz▒steczki. Skomplikowan▒
budowΩ bia│ek opisuje siΩ stosuj▒c umownie 4 poziomy organizacji strukturalnej cz▒steczki, okre╢lane ôrzΩdowo╢ci▒ö.
|
PojΩcia stosowane do opisu cz▒steczki |
Obraz cz▒steczki |
||
|
Sekwencja aminokwas≤w |
Struktura pierwszorzΩdowa |
|
|
|
Konformacja |
Struktura drugorzΩdowa |
Typy struktur: |
|
|
Motywy strukturalne: |
Motyw bab
|
||
|
Struktura trzeciorzΩdowa |
Domena
|
||
|
Struktura czwartorzΩdowa |
|
||
Oddzia│ywania reszt aminokwasowych pomiΩdzy sob▒ implikuj▒ powstanie struktur drugo-, trzecio- , a nawet czwartorzΩdowych û w przypadku bia│ek sk│adaj▒cych siΩ z kilku │a±cuch≤w polipeptydowych. D│ugi │a±cuch polipeptydowy
nie mo┐e wystΩpowaµ w roztworze, w formie ca│kowicie rozci▒gniΩtej û ulega on pofa│dowaniu. Proces fa│dowania bia│ek (ang. folding), czyli tworzenia struktur wy┐szego rzΩdu odgrywa ogromn▒ rolΩ, gdy┐ przestrzenne u│o┐enie │a±cucha polipeptydowego (jego konformacja) decyduje w znacznej mierze o funkcji bia│ka w organizmie. Fa│dowanie │a±cucha polipeptydowego mo┐e zachodziµ spontanicznie, natomiast w wiΩkszo╢ci przypadk≤w odbywa siΩ przy udziale wyspecjalizowanych bia│ek - czaperon≤w. Konformacja, w jakiej bia│ko wystΩpuje i funkcjonuje w organizmie nosi nazwΩ konformacji natywnej. Proces, w kt≤rym zostaje zniszczona konformacja przestrzenna bia│ka nazywamy denaturacj▒. WiΩkszo╢µ ╢rodk≤w denaturuj▒cych uszkadza bezpowrotnie struktury wy┐szego rzΩdu, przy zachowaniu struktury pierwszorzΩdowej.
1. Struktura pierwszorzΩdowa û czyli najni┐szy poziom organizacji strukturalnej cz▒steczki jest wyznaczona przez sekwencjΩ aminokwas≤w w │a±cuchu polipeptydowym. Jest ona uwarunkowana jeszcze zanim zostanie zsyntetyzowany │a±cuch polipeptydowy, gdy┐ informacja o kolejno╢ci aminokwas≤w w cz▒steczce bia│ka jest zakodowana w DNA, w postaci sekwencji nukleotydowej. DziΩki procesom transkrypcji, a p≤╝niej translacji sekwencja nukleotydowa zostaje odczytana w trakcie syntezy odpowiedniego polipeptydu.
2. Struktura drugorzΩdowa û s▒ to typy regularnego u│o┐enia g│≤wnego │a±cucha polipeptydowego stabilizowane wi▒zaniami wodorowymi. Struktura drugorzΩdowa jest uwarunkowana przede wszystkim w│a╢ciwo╢ciami wi▒zania peptydowego. Jego rzeczywista struktura jest po╢rednia pomiΩdzy dwoma formami ,

wskutek czego wi▒zanie pomiΩdzy atomem wΩgla grupy karbonylowej, a atomem azotu ma czΩ╢ciowo charakter wi▒zania podw≤jnego. Oznacza to, ┐e wi▒zanie peptydowe, wraz z przyleg│ymi atomami - Ca , tworzy strukturΩ p│ask▒. Pozostaje jedynie mo┐liwo╢µ obrotu wok≤│ wi▒zania C-Ca oraz Ca-N. Wielko╢µ rotacji w g│≤wnym │a±cuchu przy wi▒zaniu miΩdzy atomami wΩgla a i azotu okre╢la k▒t torsyjny j (fi), a pomiΩdzy wΩglem a i wΩglem karbonylowym û k▒t y (psi).
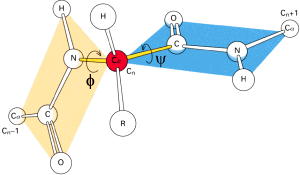
Konformacja g│≤wnego │a±cucha jest w pe│ni okre╢lona, gdy dla ka┐dej reszty aminokwasowej ustalono warto╢ci k▒t≤w j i y . Þ Reszta aminokwasowa w │a±cuchu polipeptydowym nie mo┐e przyjmowaµ dowolnej pary warto╢ci j i y , gdy┐ pewne kombinacje tych warto╢ci s▒ ca│kowicie niemo┐liwe ze wzglΩdu na zawadΩ przestrzenn▒ pomiΩdzy grupami funkcyjnymi s▒siaduj▒cych aminokwas≤w. Odkryto dwa podstawowe, regularne uk│ady drugorzΩdowe wystΩpuj▒ce powszechnie w strukturze bia│ek. S▒ to struktury a -helisy
i b -harmonijki.
a.) Struktura a
-helisy, odkryta jako pierwsza, ma kszta│t cylindra. Ciasno spleciony │a±cuch g│≤wny polipeptydu tworzy centraln▒ czΩ╢µ cylindra, natomiast boczne │a±cuchy reszt aminokwasowych wystaj▒ na zewn▒trz w u│o┐eniu helikalnym.

Struktura a -helisy jest dodatkowo stabilizowana wi▒zaniami wodorowymi grup
NH i CO g│≤wnego │a±cucha. Grupa CO ka┐dego aminokwasu wi▒┐e siΩ wi▒zaniem wodorowym z grup▒ NH, aminokwasu odleg│ego do przodu o cztery reszty aminokwasowe i le┐▒cego bezpo╢rednio nad ni▒. Rezultatem tego jest fakt, ┐e wszystkie grupy CO i NH │a±cucha g│≤wnego s▒ po│▒czone wi▒zaniem wodorowym.
Ka┐da reszta aminokwasowa jest przesuniΩta w stosunku do s▒siedniej o 0,15 nm wzd│u┐ osi helisy i obr≤cona o 100o wok≤│ osi. Na jeden obr≤t helisy przypada zatem 3,6 reszt aminokwasowych. Skok helisy wynosi wtedy 0,54 nm.
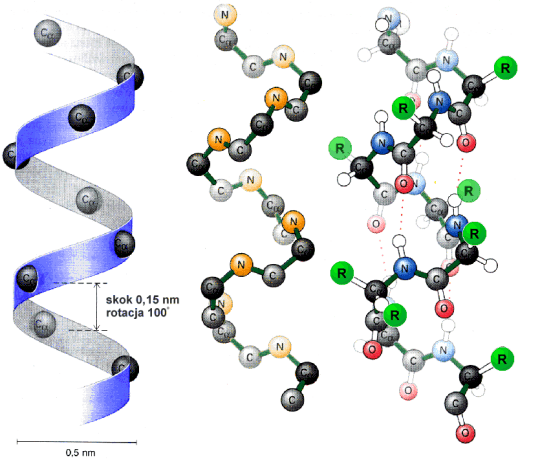
Helisa, podobnie jak ka┐da ╢ruba mo┐e byµ zar≤wno prawo, jak i lewoskrΩtna. W bia│kach wystΩpuje g│≤wnie struktura helisy prawoskrΩtnej. a -Helisa charakteryzuje siΩ tak┐e polarno╢ci▒. Jej budowa sugeruje, ┐e jest dipolem û wewnΩtrzny niepolarny rdze± oraz polarne reszty aminokwasowe wystawione na zewn▒trz cz▒steczki.
b.) Struktura b -harmonijki (b -kartki) û W odr≤┐nieniu od cylindrycznej struktury
a -helisy, cz▒steczka polipeptydu przyjmuje kszta│t, prawie ca│kowicie rozci▒gniΩty.
W uformowaniu struktury b -harmonijki, mo┐e braµ udzia│ wiΩcej ni┐ jeden │a±cuch polipeptydowy. Odleg│o╢µ s▒siednich aminokwas≤w wzd│u┐ osi cz▒steczki wynosi 0,35 nm (w a -helisie û 0,15 nm). HarmonijkΩ b stabilizuj▒ wi▒zania wodorowe pomiΩdzy grupami CO i NH, le┐▒cymi w jednej p│aszczy╝nie obok siebie
i niekoniecznie pochodz▒cych ze wsp≤lnego │a±cucha polipeptydowego.

S▒siaduj▒ce ze sob▒ │a±cuchy mog▒ byµ u│o┐one w jednym kierunku (r≤wnoleg│a b harmonijka) lub w kierunku przeciwnym (antyr≤wnoleg│a b harmonijka).

c.) Istnieje tak┐e struktura tr≤jniciowej helisy, wystΩpuj▒cej wy│▒cznie w bia│ku powszechnie wystΩpuj▒cym u ssak≤w û kolagenie. Struktura ta sk│ada siΩ z trzech │a±cuch≤w polipeptydowych o bardzo regularnej strukturze aminokwasowej. CzΩsto powtarzaj▒ca siΩ sekwencja: glicyna-prolina-hydroksyprolina (nietypowy aminokwas) (zobacz i pror≤wnaj: aminokwasy) warunkuje powstawanie struktury drugorzΩdowej.
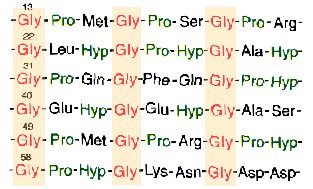
W obrΩbie pojedynczego │a±cucha nie wystΩpuj▒ wi▒zania wodorowe, za to ka┐dy z trzech │a±cuch≤w helikarnych jest stabilizowany przez odpychanie siΩ pier╢cieni pirolidynowych proliny i hydroksyproliny (zobacz i pror≤wnaj:aminokwasy), ponadto s▒ tworzone wi▒zania wodorowe pomiΩdzy s▒siaduj▒cymi aminokwasami ka┐dego z │a±cuch≤w. Trzy nici skrΩcaj▒ siΩ wok≤│ siebie tworz▒c strukturΩ superhelikalnej liny.

Typy struktur drugorzΩdowych: a -helisy i b -harmonijki wystΩpuj▒ prawie we wszystkich bia│kach
i mog▒ oddzia│ywaµ pomiΩdzy sob▒ tworz▒c bardziej z│o┐one struktury drugorzΩdowe zwane motywami.
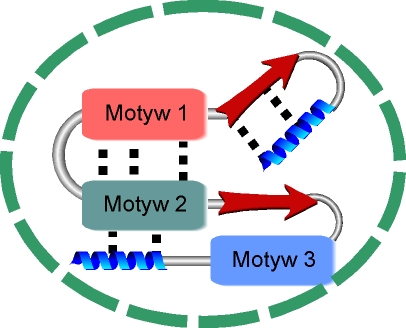
d.)Motywy strukturalne, powstaj▒ wskutek asocjacji helis a
lub b
struktur, pe│ni▒c kluczow▒ rolΩ w procesie fa│dowania siΩ bia│ka. Powodem, dla kt≤rego zachodzi to zjawisko, jest d▒┐enie tych struktur do minimalizacji ekspozycji reszt hydrofobowych w kierunku wody, a tak┐e konieczno╢µ tworzenia wi▒za± wodorowych pomiΩdzy grupami hydrofilowymi (polarnymi) w celu stabilizacji struktur, kosztem dogodnego energetycznie oddzia│ywania z polarnym rozpuszczalnikiem û wod▒. Najbardziej powszechnie wystΩpuj▒cym motywem b
, w╢r≤d bia│ek jest motyw ôszpilki do w│os≤wö (ang. harpin loop). Ten motyw jest zbudowany z jednego │a±cucha polipeptydowego, przyjmuj▒cego antyr≤wnoleg│▒ strukturΩ typu b
-harmonijki. Struktura taka tworzy siΩ dziΩki tworzeniu siΩ wi▒za± wodorowych pomiΩdzy grup▒ ûCO reszty n aminokwasu, a grup▒ ûNH reszty n + 3 aminokwasowej, powoduj▒c natychmiastowe odwr≤cenie siΩ kierunku │a±cucha i u│o┐enie antyr≤wnoleg│e struktury b
-harmonijki.

Innym przyk│adem bardziej z│o┐onej struktury opieraj▒cej siΩ na strukturze b -harmonijki jest motyw ôklucza greckiegoö. Jest to bardziej rozbudowany motyw ôszpilki do w│os≤wö, gdzie jeden │a±cuch polipeptydowy tworzy ze sob▒ cztery struktury b -harmonijki u│o┐one wzglΩdem siebie antyr≤wnoleg│e.

Struktura a -helisy podobnie jak b -harmonijki tworzy w│asne motywy strukturalne. NajczΩ╢ciej jest to motyw ôheliks-pΩtla-heliksö (ang. helix-turn-helix) wystΩpuj▒cy g│≤wnie w bia│kach wi▒┐▒cych siΩ
z DNA
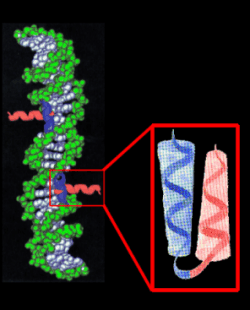
(za pomoc▒ tzw. ôpalc≤w cynkowychö).
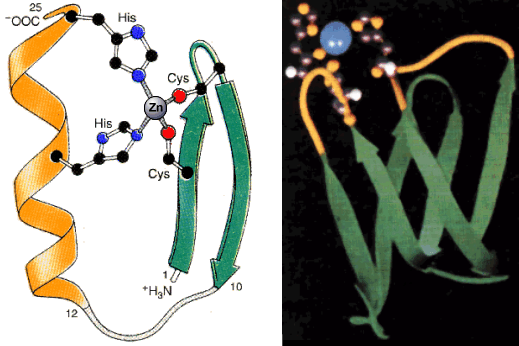
Innym przyk│adem motyw≤w a , wi▒┐▒cych siΩ z kwasami nukleinowymi s▒ struktury tzw. ôsuwak≤w leucynowychö, zbudowanych z dw≤ch oplecionych ze sob▒ a helis, bogatych w leucynΩ. Zasadowy charakter takiej struktury implikuje powinowactwo do DNA, kt≤ry ma odczyn kwa╢ny.

Opr≤cz motyw≤w jednorodnych (wy│▒cznie b lub a helikalnych), wystΩpuj▒ struktury mieszane typu a /b , przyk│adem mo┐e pos│u┐yµ motyw bab, w kt≤rym
pomiΩdzy dwoma u│o┐onymi r≤wnolegle │a±cuchami struktury b -harmonijki znajduje siΩ a -helisa. Hydrofobowa strona │a±cuch≤w b jest ciasno upakowana i kontaktuje
z hydrofobow▒ stron▒ a
-helisy.
Dotychczas zosta│y om≤wione motywy powstaj▒ce z jednego │a±cucha polipeptydowego. Bia│ka s▒ zbudowane zazwyczaj
z kilku │a±cuch≤w, fa│duj▒cych siΩ niezale┐nie od siebie i pomiΩdzy kt≤rymi r≤wnie┐ formuj▒ siΩ swego rodzaju motywy, zwane domenami, bΩd▒ce czΩsto sk│adnikami czΩ╢ci funkcjonalnych bia│ek (Np. centrum katalitycznym enzym≤w). Mo┐na wyr≤┐niµ domeny sk│adaj▒ce siΩ z czterech struktur a -helikalnych tworz▒cych z│o┐ony motyw ôheliks-pΩtla-heliksö, u│o┐onych wzajemnie r≤wnolegle, w ten spos≤b, ┐e reszty aminokwasowe poszczeg≤lnych │a±cuch≤w zazΩbiaj▒ siΩ miΩdzy sob▒ tworz▒c przestrze± hydrofobow▒ w centralnej czΩ╢ci domeny. Inn▒, bardzo podobn▒ struktur▒, charakterystyczn▒ dla bia│ek globularnych - jest domena ôglobinowaö. Powstaje ona w wyniku dopasowania grzbiet≤w jednej struktury
a
-helikarnej w grzbiet drugiej. Dwie preferowane orientacje to te, kt≤rych k▒t pomiΩdzy osiami s▒siednich helis wynosi +20o lub - 50o. W wyniku takiego u│o┐enia a
-helis powstaje centrum hydrofobowe.

Domeny s▒ tworzone tak┐e przez motywy b -harmonijki. Przyk│adem mo┐e pos│u┐yµ ôbary│ka typu b ö, gdzie centrum hydrofobowe jest os│oniΩte przez powtarzaj▒ce siΩ motywy b û ôklucza greckiegoö.

Domeny typu ôroladaö û wystΩpuj▒ce najczΩ╢ciej w bia│kach regulatorowych
i bΩd▒cymi bardziej skomplikowanymi motywami typu ôklucz greckiö.

Om≤wione powy┐ej struktury drugorzΩdowe przedstawiaj▒ tylko czΩ╢µ mo┐liwych kombinacji motyw≤w a i b wystΩpuj▒cych w bia│kach. Wy┐szym stopniem komplikacji budowy │a±cuch≤w polipeptydowych s▒ struktury trzeciorzΩdowe.
3. Struktura trzeciorzΩdowa powstaje w wyniku oddzia│ywania poszczeg≤lnych reszt aminokwasowych pomiΩdzy sob▒. Opr≤cz wi▒za± wodorowych
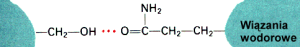
, mog▒ zostaµ utworzone tzw. ômostki solneö û w reakcji pomiΩdzy grupami funkcyjnymi pochodz▒cymi od Þ aminokwas≤w kwa╢nych (Np.: kwas glutaminowy) i zasadowych (Np.: arginina).

Bardzo charakterystycznym przyk│adem wi▒za± stabilizuj▒cych trzeciorzΩdow▒ strukturΩ bia│ek s▒ tzw. ômostki dwusiarczkoweö,

powstaj▒ce pomiΩdzy dwiema resztami cysteinowymi (zobacz i por≤wnaj: aminokwasy). Innymi mo┐liwymi interakcjami pomiΩdzy grupami aminokwasowymi s▒ oddzia│ywania apolarnych reszt bΩd▒ce przyk│adem oddzia│ywania tzw. si│ van der Waalsa. S▒ to oddzia│ywania pomiΩdzy aminokwasami zawieraj▒cymi silnie hydrofobowe grupy funkcyjne
(Np.: fenyloalanina-fenyloalanina).

Kolejnymi wa┐nymi czynnikami warunkuj▒cym strukturΩ trzeciorzΩdow▒ s▒ oddzia│ywania reszt aminokwasowych z
rozpuszczalnikiem. Ostateczna konformacja bia│ek rozpuszczalnych w wodzie jest taka, ┐e wiΩkszo╢µ apolarnych reszt aminokwasowych koncentruje siΩ we wnΩtrzu cz▒steczki, wypychaj▒c z niej wodΩ, natomiast reszty polarne û nios▒ce │adunek elektryczny wysuwaj▒ siΩ na zewn▒trz i ulegaj▒ hydratacji (zobacz rysunek). Cz▒steczka bia│ka jest otoczona warstw▒ zwi▒zanej wody hydratacyjnej.
4. Struktura czwartorzΩdowa jest charakterystyczna dla bia│ek oligomerycznych. (zawieraj▒cych kilka podjednostek). Podjednostki bia│ek s▒ to niezale┐nie sfa│dowane │a±cuchy polipeptydowe lub ca│e bia│ka, bΩd▒ce tylko sk│adnikiem du┐ego kompleksu bia│kowego. Podobny zestaw oddzia│ywa± reszt aminokwasowych pomiΩdzy sob▒
oraz z rozpuszczalnikiem jest charakterystyczny dla czynnik≤w stabilizuj▒cych strukturΩ czwartorzΩdow▒ bia│ek oligomerycznych. CzΩsto siΩ zdarza, ┐e powierzchnie styku poszczeg≤lnych podjednostek oligomeru zawieraj▒ du┐▒ ilo╢µ aminokwas≤w hydrofobowych. Efektem tego jest ôsklejenieö podjednostek i ôuszczelnienieö przed wnikniΩciem rozpuszczalnika. Rozbicie podjednostek oznacza destabilizacjΩ dalszych struktur, gdy┐ jest to wysoce niekorzystne energetycznie poniewa┐ zachodzi kontakt
z polarnym rozpuszczalnikiem. Struktura czwartorzΩdowa staje siΩ szczeg≤lnie trwa│a gdy podjednostki wi▒┐▒ siΩ ômostkamiö dwusiarczkowymi lub solnymi.

Podobie±stwo pomiΩdzy poszczeg≤lnymi motywami, domenami
lub podjednostkami, wskazuje na silne d▒┐enie do konserwowania (utrwalania) ôudanych funkcjonalnieö struktur bia│kowych w trakcie ewolucji. Jest to najlepszy
i najszybszy spos≤b tworzenia nowych struktur û z ju┐ wcze╢niej dostΩpnych, lecz
w odmiennej kombinacji. Gdyby ewolucja sz│a drog▒ kombinatoryki i szuka│a wszystkich mo┐liwych kombinacji konformacji struktur bia│ka i zak│adaj▒c przeciΩtny czas fa│dowania siΩ (foldingu) bia│ka ok. 10-1 û 10-2 s to czas potrzebny na wypr≤bowanie wszystkich mo┐liwo╢ci wyni≤s│by w przybli┐eniu 10100 lat.

Tworzenie nowych bia│ek polega na sk│adaniu gen≤w koduj▒cych struktury ju┐ istniej▒ce. Utworzenie w pe│ni funkcjonalnego bia│ka odbywa siΩ w trakcie Þ modyfikacji potranslacyjnej, w kt≤rej s▒ dodawane inne, niebia│kowe elementy struktury. W tym procesie formowany jest ostateczny kszta│t bia│ka w wyniku jego przebudowy. Wszystkie te czynno╢ci nie przebiegaj▒ spontanicznie i s▒ przeprowadzane dziΩki wyspecjalizowanym enzymom. Jako przyk│ad mog▒ pos│u┐yµ specyficzne bia│ka û czaperony (ôbia│ka opieku±czeö), kt≤re kontroluj▒ proces w│a╢ciwego fa│dowania siΩ │a±cucha polipeptydowego. Odpowiedzialne s▒ one tak┐e, za usuwanie nieprawid│owo sfa│dowanych │a±cuch≤w, wykazuj▒c zdolno╢µ do tworzenia kompleks≤w ze ╝le uformowanym bia│kiem i zwiΩkszaj▒c podatno╢µ takiego konglomeratu na dzia│anie enzym≤w proteolitycznych.

⌐ 1997, 1998 Biologia Molekularna w Internecie Webmaster