
Modyfikacje potranslacyjne
1. Obr≤bka proteolityczna odbywa siΩ przy pomocy enzym≤w zwanych peptydazami, kt≤re s▒ odpowiedzialne za ciΩcie │a±cuch≤w polipeptydowych na ko±cu │a±cucha (egzopeptydazy) lub w jego ╢rodku (endopeptydazy). WiΩkszo╢µ tych enzym≤w jest bardzo specyficzna - rozpoznaj▒ one miejsce ciΩcia na podstawie sekwencji aminokwasowej. Dobrym przyk│adem mo┐e pos│u┐yµ proinsulina, kt≤rej pierwotny │a±cuch polipeptydowy jest przecinany w okre╢lonych miejscach, nastΩpnie dwa produkty s▒ │▒czone za pomoc▒ ômostk≤wö dwusiarczkowych.

Istnieje kilka innych przyk│ad≤w obr≤bek proteolitycznych:
- aktywacja bia│ka, poprzez wyciΩcie niepotrzebnego fragmentu │a±cucha polipeptydowego
- usuniΩcie sekwencji liderowych (fragment≤w │a±cucha, kt≤re kieruj▒ bia│ko do odpowiedniego przedzia│u kom≤rkowego)
- w przypadku poliprotein p│aszcza niekt≤rych wirus≤w û pociΩcie na fragmenty, aktywuje ka┐dy z otrzymanych fragment≤w
- rzadko wystΩpuj▒cy splicing polipeptydowy (podobnie jak obr≤bka preRNA) û wycinanie fragment≤w ze ╢rodka │a±cucha polipeptydowego
- usuwanie pierwszego podstawnika (metioniny lub formylometioniny) wystΩpuj▒ce u prawie 50% wszystkich bia│ek
2. N-acetylacja , N-formylacja, N-metylacja s▒ rodzajami modyfikacji potranslacyjnych bia│ek, w kt≤rych nastΩpuje przy│▒czenie do N-ko±ca │a±cucha polipeptydowego grup acetylowych (acetylacja), metylowych (metylacja) lub metioniny (formylacja).
3. Glikozylacja û w tym procesie nastΩpuje do│▒czenie reszt cukrowcowych do bia│ek (Np.: bia│ek b│onowych).

4. Hydroksylacja û w przypadku aminokwas≤w proliny i lizyny û do│▒czenie
grupy ûOH (Rys).
5. Poli (ADP)-rybozylacja û do│▒czanie reszt adeninowych.
6. Fosforylacja û aktywacja bia│ka poprzez do│▒czenie reszty fosforanowej przez specyficzne enzymy - kinazy. Bardzo powszechnie wystΩpuj▒ce w╢r≤d bia│ek (Np.: czynniki transkrypcyjne).
7. Defosforylacja - deaktywacja bia│ka przez usuniΩcie reszty fosforanowej przez specyficzne enzymy - fosfatazy.
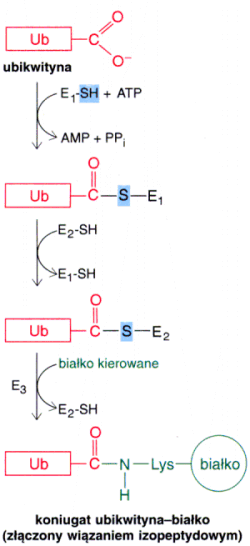
8. Ubikwitynacja û (u organizm≤w Eukariotycznych) do│▒czenie innego bia│ka û ubikwityny powoduje, ┐e bia│ko jest przeznaczone do degradacji. W procesie ubikwitynacji s▒ usuwane (degradowane) bia│ka ╝le sfa│dowane, wadliwe oraz takie kt≤rych ö┐ycieö dobieg│o ko±ca. Czas p≤│trwania bia│ka jest zale┐ny od rodzaj≤w aminokwas≤w wystΩpuj▒cych na jego N-ko±cu.
9. Modyfikacja potranslacyjna bia│ek obejmuje tak┐e procesy do│▒czania reszt lipidowych (lipoproteiny), a tak┐e jon≤w metali (w przypadku bia│ek z│o┐onych), kt≤re za pomoc▒ wi▒za± jonowych │▒cz▒ siΩ z odpowiednimi grupami funkcyjnymi aminokwas≤w i stanowi▒ centra aktywne dla wielu enzym≤w (np.: hemoglobina û Fe).
Heterogenno╢µ sk│adu aminokwasowego, tworzonych struktur, rodzaj≤w modyfikacji, a tak┐e po│▒cze± z innymi niebia│kowymi substancjami implikujΩ ogromn▒ r≤┐norodno╢µ funkcji, kt≤re bia│ka pe│ni▒ w organizmie, a tak┐e ich w│a╢ciwo╢ci fizyko-chemicznych.

⌐ 1997, 1998 Biologia Molekularna w Internecie Webmaster







